
Заведующий лабораторией
Коржевский Дмитрий Эдуардович, доктор медицинских наук, профессор РАН
e-mail: iemmorphol@iemspb.ru
Телефон: (812) 234-24-38
Краткая история лаборатории
В 1932 г. выдающийся советский учёный, основоположник эволюционной гистологии, академик Алексей Алексеевич Заварзин организовал и возглавил Отдел общей морфологии Всесоюзного института экспериментальной медицины. В составе отдела было сформировано несколько лабораторий, в том числе Лаборатория экспериментальной гистологии, которую возглавил проф. Николай Григорьевич Хлопин. От нее и ведет свое начало Лаборатория функциональной морфологии центральной и периферической нервной системы.
В 1945 г. лаборатория была реорганизована в Отдел гистологии.
После Н.Г. Хлопина заведующим отделом по совместительству был член-корр. АМН СССР Серафим Иванович Щелкунов.
В 1956 г. и.о. руководителя Отдела гистологии короткое время был член-корр. АМН СССР Павел Григорьевич Светлов.
В 1960 г. руководителем Лаборатории экспериментальной гистологии стал проф. Владимир Павлович Михайлов, под руководством которого работали такие выдающиеся ученые как д.б.н, проф., член-корр. РАН Сергей Александрович Кетлинский, д.м.н., проф., член-корр. РАН Андрей Семёнович Симбирцев и др.
В 1980 г. Лаборатория экспериментальной гистологии входит в состав вновь организованного Отдела морфологии вместе с Лабораторией цитологии (руководитель — член-корр. РАМН Владимир Александрович Отеллин).
В 2008 г. лаборатория получает название «Лаборатория функциональной морфологии центральной и периферической нервной системы» (руководитель — проф. РАН Д.Э. Коржевский) и входит в состав реорганизованного академиком РАМН В.А. Нагорневым Отдела общей и частной морфологии.
Основные направления исследований
| Изучение медиаторных систем головного мозга с помощью селективных иммуномаркеров;
Изучение глиоархитектоники различных областей мозга лабораторных животных и человека; Исследование малых цитологических структур (клеточных контактов, синапсов, внутриядерных структур) с использованием микроскопии сверхвысокого разрешения; Исследование особенностей иннервации периферических органов с помощью современных иммуногистохимических методов; Исследование дифференцировки нейральных клеток-предшественников и мезенхимных стволовых клеток в условиях аллотрансплантации в периферический нерв. |
|
Основные научные результаты за последние 5 лет
- Подробно описаны морфофункциональные изменения нейронов, микроглиоцитов и астроцитов головного мозга крысы после кратковременной фокальной ишемии.
- Охарактеризованы структурные особенности и цитохимические характеристики эпендимоцитов желудочков мозга крысы на разных стадиях онтогенеза и при ишемическом повреждении.
- В области медиальной части поводка впервые выявлены особые GFAP–иммунопозитивные эпендимоциты с длинными радиальными отростками. Сформулирована гипотеза о формировании этими клетками резервной нейрогенной зоны промежуточного мозга.
- Изучены цитохимические особенности таницитов третьего желудочка головного мозга крысы на разных стадиях постнатального развития. Впервые охарактеризованы особенности структурно-функциональной организации ядрышек таницитов.
- Впервые показано присутствие амилоидных скоплений в почке, печени и миокарде мышей линии mdx (экспериментальная модель мышечной дистрофии Дюшенна), описаны их локализация, морфология и биохимический состав.
- Изучены морфологические особенности и тинкториальные свойства амилоидных скоплений в миокарде человека и амилоидных бляшек в мозге людей с болезнью Альцгеймера.
- Дана полная иммуногистохимическая характеристика катехоламинергических нейронов черного вещества головного мозга человека, описаны особенности организации внутриядерных структур этих нейронов (ядрышек, телец Маринеско, телец Кахаля).
- Установлено, что в нейротрансплантатах эмбрионального неокортекса крысы, развивающихся в несвойственной для них биологической нише, нарушаются процессы пролиферации, приводящие к изменению клеточного цикла нейроэпителиальных клеток, которые коррелируют с нарушением распределения кадгерин-содержащих клеточных контактов и с нарушением интеркинетической миграции ядер клеток трансплантатов.
- Показано, что МСК костномозгового происхождения, введенные в головной мозг, обнаруживают фибробластоподобный рост в течение первой недели наблюдения.
- Установлено, что после введения МСК в поврежденный нерв, они сохраняют жизнеспособность в течение недели, часть из них локализуются в оболочках нерва и дифференцируется в адипоциты и клетки периневрия.
- На основе иммуногистохимических методов выявления периферина, белка ПГП 9.5, тирозингидроксилазы разработаны новые подходы для селективного выявления нервных аппаратов в различных внутренних органах человека и лабораторных животных.
Протоколы иммуногистохимических реакций, отработанные сотрудниками лаборатории
| Иммуноцитохимическая реакция на белок S100
Белок S100 — кальций-связывающий белок, получивший свое название благодаря растворимости в насыщенном растворе сульфата аммония (от англ. Solubility-растворимый). Установлено, что S100 — это семейство, включающее в себя 25 белков с молекулярной массой около 10,5 кДа. Основная масса белков семейства S100 (до 85-90% от общего содержания в нервной ткани) сосредоточена в астроцитах; 10-15% – экспрессируется в нейронах, минимальное их количество определяется в олигодендроцитах. Также экспрессия этих белков характерна для глиальных элементов периферической нервной системы.Протокол окраски отработан для поликлональных кроличьих антител к S100 (Z0311, Dako, Дания) без применения методов демаскирования антигена.Подробнее – см. статьи:Колос Е.А., Коржевский Д.Э. Виментин и белок S100 в клетках формирующегося чувствительного узла спинномозгового нерва // Морфология. 2013. Т. 143. № 3. С. 73-74.Петрова Е.С., Павлова Н.В., Коржевский Д.Э. Современные морфологические подходы к изучению регенерации периферических нервных проводников // Медицинский академический журнал. 2012. Т. 12. № 3. С. 15-29. Последовательность обработки препаратов
|
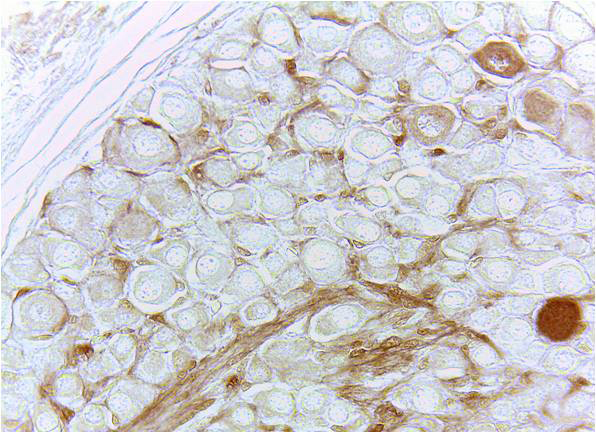 Результат окраски по данному протоколу срезов спинномозгового ганглия новорожденной крысы. |
| Иммуноцитохимическая реакция на белок PGP 9,5
Семейство белков, идентифицированных в семидесятых годах прошлого века, в гомогенате головного мозга человека с применением двумерного электрофореза в полиакриламидном геле получило название «Protein gene products» или сокращенно PGP. В зависимости от расстояния миграции в полиакриламидном геле, белки получили числовые обозначения. Одним из таких специфических для нервной ткани белков был PGP 9.5 – протеин с молекулярной массой 27 кДа. Показано, что PGP 9.5 является удобным нейрональным маркером для центральной и периферической нервной системы и широко применяется для исследования иннервации различных органов. Интенсивно окрашиваются не только перикарионы всех нервных клеток, но и аксоны крупных сенсорных и двигательных нейронов, а также вегетативные нервные волокна. Из клеток, не относящихся к нервным и нейроэндокринным, но содержащим значительное количество PGP 9.5 следует отметить сперматогонии, ооциты и клетки Лейдига. PGP 9.5 считается цитоплазматическим белком, однако 5% нейронов в центральной и периферической нервной системе имеют положительную ядерную реакцию Протокол окраски отработан для поликлональных кроличьих антител к PGP 9.5 (E334, Spring Bioscience, США) без применения методов демаскирования антигена. Данный протокол применяется для выявления нервных структур (ганглиев, нервных стволов, нервных пучков, нервных сплетений, нервных окончаний) периферической нервной системы и нейроэндокринных клеток. Подробнее – см. статью Коржевский Д.Э., Сухорукова Е.Г., Петрова Е.С., Цуканова А.Ф., Чумасов Е.И. Применение иммуногистохимической реакции на белок PGP 9.5 для изучения иннервации сердца крысы и человека // Морфология. 2013. Т. 143. № 3. С. 77-80. Последовательность обработки препаратов
В результате проведения реакции нервные структуры окрашиваются в коричневый цвет. При подкраске препаратов астровым синим цитоплазматические структуры окрашиваются в сине-зеленый цвет. Результат обработки по данному протоколу препарата поджелудочной железы (А) и сердца (Б) крысы представлен на фотографиях. Нервные структуры сердца и поджелудочной железы, а также клетки островков Лангерганса содержат белок PGP 9.5. |
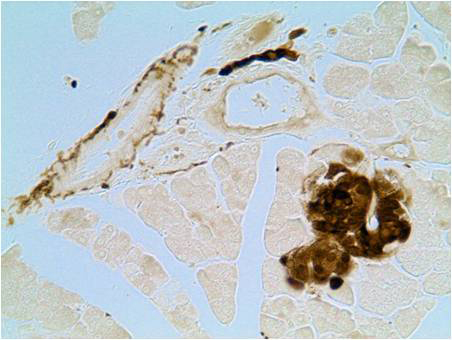 А – Результат обработки по данному протоколу препарата поджелудочной железы крысы
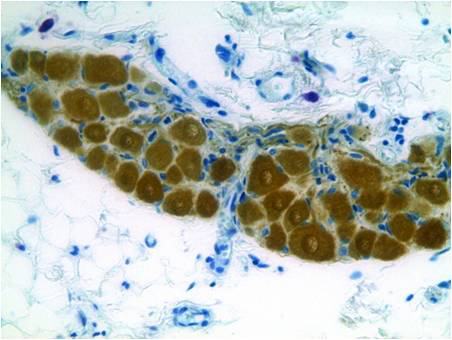 Б – Результат обработки по данному протоколу препарата сердца крысы |
| Иммуноцитохимическая реакция на серотонин (5-гидрокситриптамин, 5-HT)
Реакция используется для выявления серотонина (5-HT) в клетках различной локализации, способных синтезировать или накапливать этот моноамин. У млекопитающих 5-HT выявляется в серотонинергических нейронах ядер шва, EC-клетках, присутствующих в составе эпителия пищеварительного тракта, клетках карциноидных опухолей различной локализации. В представленном протоколе могут быть использованы первичные поликлональные (кроличьи) антитела NCL-SEROTp (Novocastra, UK) в разведении 1:200 без применения методов теплового демаскирования антигена. На основе проверки различных протоколов выявления 5НТ-иммунореактивных клеток был установлен оптимальный вариант обработки препаратов. Подробнее – см. статью: Коржевский Д.Э., Драй Р.В., Костюкевич С.В. Иммуноцитохимический метод выявления EC- (энтерохромаффинных) клеток эпителия слизистой оболочки кишки крысы // Морфология. 2008. 133(1):78-81. Последовательность обработки препаратов:
Общее время обработки обычно составляет 2,5-3,0 ч. Результат обработки по данному протоколу препарата тонкой кишки человека представлен на фотографии. |
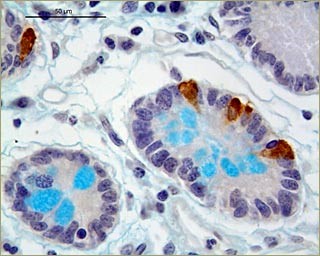 Результат обработки по данному протоколу препарата тонкой кишки человека |
| Иммуноцитохимическая реакция на глиальный фибриллярный кислый белок (ГФКБ, GFAP)
Белок GFAP участвует в формировании промежуточных филаментов (компонент цитоскелета) астроцитов головного мозга. Считается, что реакция на GFAP является аналогом золото-сублиматного метода импрегнации по Кахалю – одного из классических методов выявления астроцитарной глии. Реакция, проводимая согласно представленному протоколу, может быть использована для выявления GFAP-иммунопозитивных астроцитов в интактной нервной ткани и при патологических состояниях ЦНС. Протокол отработан для поликлональных кроличьих антител (N1506, Dako, Дания) и моноклональных мышиных антител (клон SPM507, Spring Bioscience, США, в разведении 1:100) без применения методов демаскирования антигена. Подробнее – см. статью Сухорукова Е.Г., Коржевский Д.Э., Кирик О.В., Коржевская В.Ф. Иммуногистохимическое выявление астроцитов головного мозга при черепно-мозговой травме // Судебно-медицинская экспертиза, 2010, 1: 14-16. Последовательность обработки препаратов:
Общая продолжительность протокола обработки препаратов составляет 2 ч 15 мин. Результаты обработки по данному протоколу срезов головного мозга человека (а) и крысы (б) представлены на фотографиях. |
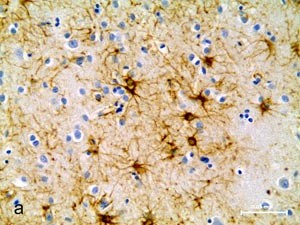 Результаты обработки по данному протоколу срезов головного мозга человека
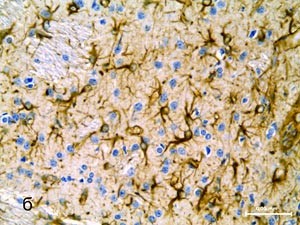 Результаты обработки по данному протоколу срезов головного мозга крысы |
| Иммуноцитохимическая реакция на ядерный белок NeuN
Реакция используется для выявления нейронов. В представленном протоколе могут быть использованы первичные моноклональные мышиные антитела к NeuN (клон А60, Chemicon, США) в разведении 1:400 без применения методов теплового демаскирования антигена. Подробнее – см. статью: Коржевский Д.Э., Гилерович Е.Г, Зинькова Н.Н. [и др.] Иммуногистохимическое выявление нейронов головного мозга с помощью селективного маркера NeuN // Морфология. 2005. 128(5):76-78. Последовательность обработки препаратов:
Общее время обработки обычно составляет 2,5-3,0 ч. Результат обработки по данному протоколу препарата головного мозга крысы в области третьего желудочка представлен на фотографии. |
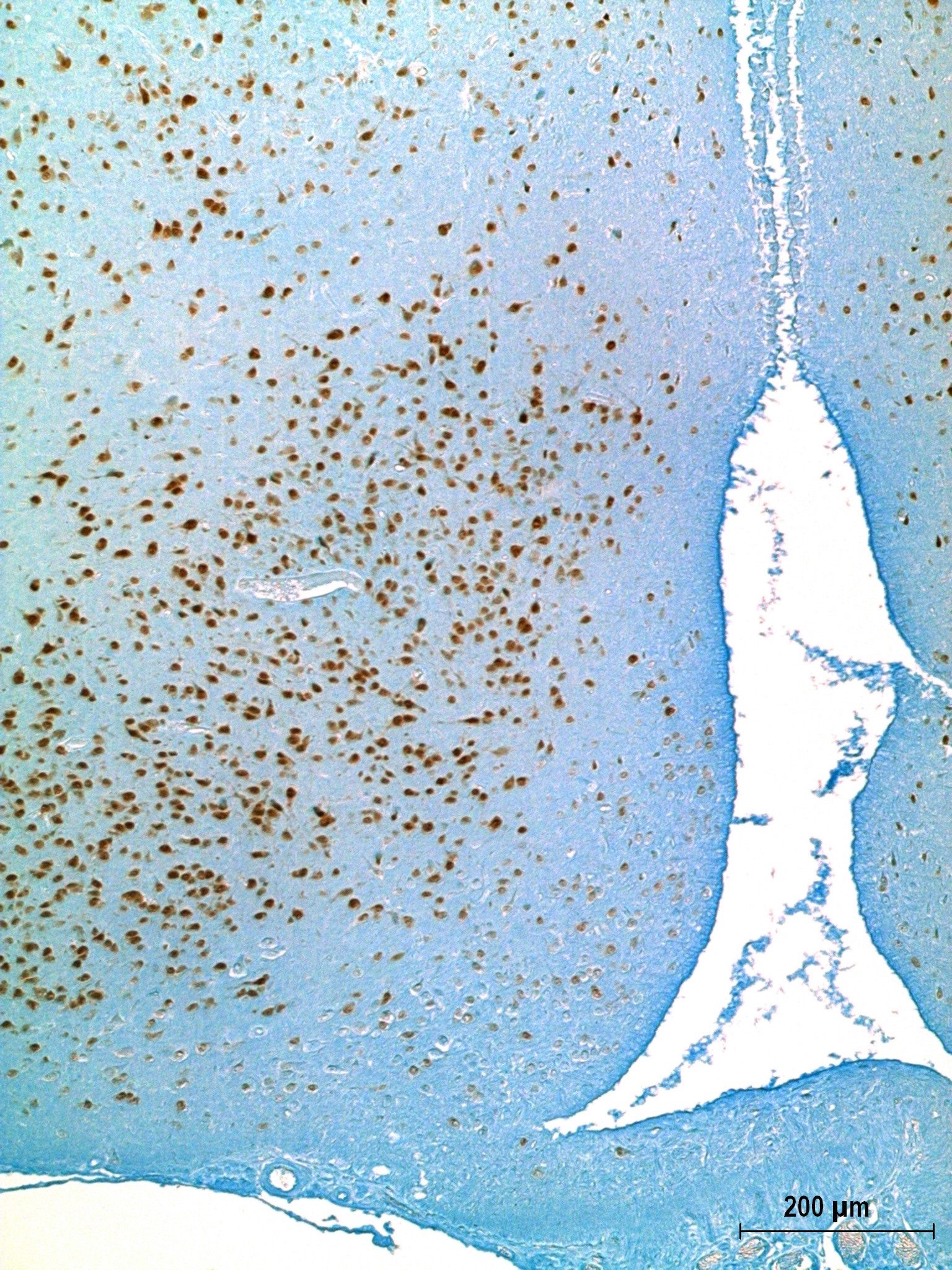 Результат обработки по данному протоколу препарата головного мозга крысы в области третьего желудочка |
Наиболее значимые публикации за последние 5 лет
- Gusel’nikova V.V., Korzhevskiy D.E. NeuN as a neuronal nuclear antigen and neuron differentiation marker // Acta Naturae, 2015, 7(2):42–47.
- Korzhevskii D.E., Kirik O., Sukhorukova E. Immunocytochemistry of microglial cells // Neuromethods, 2015, 101:209–224. DOI: 10.1007/978-1-4939-2313-7_12.
- Nurkhametova D., Kudryavtsev I., Guselnikova V., Serebryakova M., Giniatullina R.R., Wojciechowski S., Tore F., Rizvanov A., Koistinaho J., Malm T., Giniatullin R. Activation of P2X7 Receptors in Peritoneal and Meningeal Mast Cells Detected by Uptake of Organic Dyes: Possible Purinergic Triggers of Neuroinflammation in Meninges // Front Cell Neurosci, 2019, 13:45. DOI: 10.3389/fncel.2019.00045.
- Korzhevskii D.E., Gusel’nikova V.V., Kirik O.V., Sukhorukova E.G., Grigorev I.P. The Spatial Organization of the Intranuclear Structures of Human Brain Dopaminergic Neurons // Acta Naturae, 2017, 9, 3(34):85–92.
- Koroleva K., Gafurov O., Guselnikova V., Nurkhametova D., Giniatullina R., Sitdikova G., Mattila O.S., Lindsberg P.J., Malm T.M., Giniatullin R. Meningeal Mast Cells Contribute to ATP-Induced Nociceptive Firing in Trigeminal Nerve Terminals: Direct and Indirect Purinergic Mechanisms Triggering Migraine Pain // Front Cell Neurosci, 2019, 10(13):195. DOI: 10.3389/fncel.2019.00195.
- Gusel’nikova V., Antimonova O., Fedorova E., Shavlovsky M., Krutikov A., Mikhailova E., Gudkova A., Mikhailov V., Korzhevskii D. Fluorescent characterization of amyloid deposits in the kidneys of MDX mice // European Journal of Histochemistry, 2018, 62:2870. DOI: 4081/ejh.2018.2870.
- Gusel’nikova V., Nurkhametova D., Kudryavtsev I. et al. Extracellular ATP induces activation and degranulation of meningeal mast cells through P2X7 receptor: a possible mechanism for migraine pain // FEBS OPEN BIO, 2018, 8: 374. DOI: https://doi.org/10.1002/2211-5463.12453.
- Petrova E., Isaeva E., Kolos E., Korzhevskii D. Allogeneic bone marrow mesenchymal stem cells in the epineurium and perineurium of the recipient rat // Biological Communications, 2018, 63(2):123–132. DOI: 10.21638/spbu03.2018.205.
- Alekseeva O.S., Gusel’nikova V.V., Beznin G.V., Korzhevskii D.E. Prospects for the application of NeuN nuclear protein as a marker of the functional state of nerve cells in vertebrates // Journal of Evolutionary Biochemistry and Physiology, 2015, 51(5): 357-369. DOI: 10.1134/S0022093015050014.
- Petrova E.S. Differentiation potential of mesenchymal stem cells and stimulation of nerve regeneration // Russian Journal of Developmental Biology, 2018, 49(4):193–205. DOI:1134/S0475145018010032.
- Kolos E.A., Korzhevskii D.E. Activation of Microglyocytes in the Anterior Horns of Rat Spinal Cord after Administration of Bacterial Lipopolysaccharide // Bull Exp Biol Med, 2017, 163(4): 515-518. DOI: 10.1007/s10517-017-3841-8.
- Kolos E.A., Korzhevskii D.A. Heterogeneous choline acetyltransferase staining in cholinergic neurons // Neurochemical Journal, 2016, 10(1):47-52. DOI: 10.1134/S1819712416010104.
- Sukhorukova E. G., Kirik O.V., Sufieva D.A., Alekseeva O.S., Korzhevskii D.E. Structural Organization of Astrocytes in the Subgranular Zone of the Rabbit Hippocampal Dentate Fascia // Journal of Evolutionary Biochemistry and Physiology, 2019, 55(2):148–154. DOI: 10.1134/S002209301902008X.
- Sufieva D.A., Guselnikova V.V., Korzhevskii D.E. Nucleolin in Neurons of the Human Substantia Nigra // Biochemistry (Moscow), Supplement Series A: Membrane and Cell Biology, 2018, 12(2): 205–208.
- Petrova E.S., Isaeva E.N., Kolos E.A., Korzhevskii D.E. Vascularization of the Damaged Nerve under the Effect of Experimental Cell Therapy // Bull Exp Biol Med, 2018, 165(1):161-165. DOI: 10.1007/s10517-018-4120-z.
- Alekseeva O.S., Grigor’ev I.P., Korzhevskii D.E. Neuroglobin, an oxygen-binding protein in the mammalian nervous system (localization and putative functions) // Journal of Evolutionary Biochemistry and Physiology, 2017, 53(4):249–258. DOI:1134/S0022093017040019 .
- Sufieva D.A., Kirik O.V., Korzhevskii D E. Astrocyte Markers in the Tanycytes of the Third Brain Ventricle in Postnatal Development and Aging in Rats // Russian Journal of Developmental Biology, 2019, 50(3): 146–153. DOI: 10.1134/S1062360419030068.
- Kolos E.A., Korzhevskii D.E. Glutamine Synthetase-Containing Cells of the Dorsal Root Ganglion at Different Stages of Rat Ontogeny // Russian Journal of Developmental Biology, 2018, 49(3): 179–183 DOI:7868/S0475145018030060.
- Korzhevskii D.E., Grigor’ev I.P., Sukhorukova E.G., Gusel’nikova V.V. Immunohistochemical characteristics of neurons in the Substantia Nigra of the human brain // Neuroscience and Behavioral Physiology, 2019, 49(1): 109-114.
- Fedorova E.A., Sufieva D.A., Grigorev I.P., Korzhevskii D.E. Mast Cells of the Human Pineal Gland // Advances in Gerontology, 2019, 9(1): 62–66. DOI: 10.1134/S2079057019010053.
- Gusel’nikova V.V., Antimonova O.I.,Fedorova E.A. Fluorene derivative disodium salt as a new fluorescent dye for Identification of amyloid deposits in myocardium of mdx mice // Cell and Tissue Biology, 2018, 12(3):213–216. DOI: https://doi.org/10.1134/S1990519X18030057.
- Kirik O.V., Grigorev I.P., Alekseeva O.S., Korzhevskii D.E. Three-dimensional organization of the cytoplasmic neuroglobin-immunopositive structures in the rat medulla oblongata neurons// Biochemistry (Moscow) Supplement Series A Membrane and Cell Biology, 2016, 10(4):333-337. DOI: 10.1134/S1990747816030065
- Sufieva D.A., Kirik O.V., Korzhevskii D.E. Nucleolin and Nucleoli in Ependymocytes and Tanycytes of the Third Ventricle of the Rat Brain // Cell and Tissue Biology, 2018, 12(2):166–172). DOI: 1134/S1990519X18020116.
- Chumasov E.I., Petrova E.S., Korzhevskii D.E. Age-related changes in the sympathetic innervation of the pancreas // Russian Journal of Developmental Biology, 2017, 48 (4): 278-286. DOI: 10.1134/S1062360417040038.
- Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Структурные и функциональные особенности эндотелия сосудов сердца половозрелых крыс по данным иммуногистохимического исследования // Регионарное кровообращение и микроциркуляция, 2019, 18, 2(70):70–77. DOI: 10.24884/1682-6655-2019-18-2-70-77.
- Guselnikova V.V., Gudkova A.Ya., Semernin E.N., Grudinina N.A., Krutikov A.N., Shavloskii M.M., Mil’man B.L., Korzhevskii D.E., Mikhailova E.V., Kaminskaya E.V., Mikhailov V.M. Characterization of amyloid deposits found in internal organs of mdx mice // Cell and Tissue Biology, 2017, 11(1):27-34. DOI: 10.1134/S1990519X17010047.
- Чумасов Е.И., Петрова Е.С., Коржевский Д.Э. Структурно-функциональная характеристика эндотелиальных клеток сосудов сердца новорожденной крысы (иммуногистохимическое исследование) // Регионарное кровообращение и микроциркуляция. 2018. 17(2):80–85. DOI: 10.24884/1682-6655-2018-17-2-78-83.
- Чумасов Е.И., Колос Е.А., Петрова Е.С., Коржевский Д.Э. Иммуногистохимия периферической нервной системы. СПб.: СпецЛит, 2020. 111 с.
- Sufieva D.A., Razenkova V.A., Antipova M.V., Korzhevskii D.E. Microglia and tanycytes of the infundibular recess of the brain in early postnatal development and during aging // Russ. J. Dev. Biol. 2020. Vol. 51. № 3. P. 189–196. DOI: 10.1134/S106236042003008X
- Tsyba, D.L., Kirik, O.V., Kolpakova, M.E. et al. Expression of nestin and glial fibrillary acidic protein in the marginal ischemic zone of the brain in SHR Rats // Bull. Exp .Biol. Med. 2020. Vol. 169. № 4. P. 576-581. DOI: 10.1007/s10517-020-04932-4
- Kolos, E.A., Korzhevskii, D.E. Immunohistological detection of active satellite cells in rat dorsal root ganglia after parenteral administration of lipopolysaccharide and during aging // Bull. Exp. Biol. Med. 2020. Vol. 169. № 5. P. 665–668.DOI: 10.1007/s10517-020-04950-2
- Гусельникова В.В., Антимонова О.И., Федорова Е.А., Шавловский М.М., Сафрай А.Е., Рукавишникова А.А., Ильин В.В., Мильман Б.Л., Коржевский Д.Э. Новая технология выявления амилоида в тканях человека, основанная на использовании флуоресцентного красителя – аналога конго красного // Современные технологии в медицине. 2020. Т. 12. № 1. С. 65-71. DOI: 10.17691/stm2020.12.1.08
- Колос Е.А., Коржевский Д.Э. Микроглия спинного мозга в норме и при патологии // Acta naturae. 2020. V. 12. № 1. С. 4- 17. DOI: 10.32607/actanaturae.10934

Сотрудники Лаборатории функциональной морфологии центральной и периферической нервной системы (2017 г.)
Участие в конференциях сотрудников Лаборатории функциональной морфологии центральной и периферической нервной системы Отдела общей и частной морфологии
Сотрудники лаборатории

Григорьев Игорь Павлович
Сфера научных интересов: биохимия и морфология нервной системы.

Кирик Ольга Викторовна
Сфера научных интересов: нейробиология, молекулярная биология, конфокальная лазерная микроскопия.

Алексеева Ольга Сергеевна
Сфера научных интересов: нейрофизиология, иммуногистохимия, белки теплового шока, гипоксия, гипероксия.

Колос Елена Андреевна
Сфера научных интересов: гистогенез и цитохимия спинного мозга и спинномозговых ганглиев.

Федорова Елена Анатольевна
Сфера научных интересов: структура спинного мозга и мозжечка в норме и патологии, амилоидозы.

Шатило Лариса Николаевна
Сфера научных интересов: экспериментальная гистология, современные методы изготовления гистологических препаратов.




