
Заведующий лабораторией
Паткин Евгений Львович, доктор биологических наук, профессор
e-mail: molgen@iemspb.ru
 |
Эмблема лаборатории (автор Сучкова И.О., 2000 г.) |
Краткая история лаборатории
В 1932 г. во Всесоюзном институте экспериментальной медицины в составе Отдела общей морфологии (зав. академик А.А. Заварзин) была создана Лаборатория экспериментальной эмбриологии (зав. профессор П.П. Иванов). В 1956 г. в ИЭМ была воссоздана Лаборатория эмбриологии под руководством Павла Григорьевича Светлова, в задачи которой входило изучение развития высших позвоночных, причем главным подходом к выяснению закономерностей нормального развития была оценка чувствительности эмбрионов или отдельных зачатков к различным повреждающим агентам. В 1960 г. Павел Григорьевич сформулировал теорию критических периодов развития, которая заключалась в том, что наиболее высокой чувствительностью к повреждающим агентам обладают зародыши во время имплантации и плацентации (что соответствует 1-й и 3-8-й неделям эмбриогенеза человека).
В 1963 г. Лаборатория вошла в состав вновь созданного Отдела эмбриологии, который возглавил профессор, доктор медицинских наук Андрей Павлович Дыбан — талантливый исследователь, задавший ряд направлений в развитии отечественной экспериментальной эмбриологии. Он внёс значительный вклад в экспериментальную цитогенетику развития млекопитающих, создал новую технику хромосомного анализа ранних зародышей млекопитающих, что позволило ему вместе с сотрудниками детально проанализировать влияние числовых и структурных хромосомных аберраций на ключевые звенья эмбриогенеза. На основании полученных данных А.П. Дыбан сформулировал новые представления о роли различных хромосом в раннем развитии и о сочетанном участии генов и эпигеномных факторов в контролирующих механизмах раннего эмбриогенеза млекопитающих.
Сотрудники Отдела эмбриологии изучали молекулярные и клеточные механизмы, контролирующие нормальный и патологический эмбриогенез млекопитающих с целью разработки научных основ эффективной профилактики врожденных аномалий и пороков развития. На протяжении ряда лет ими изучались механизмы спонтанного и индуцированного тератогенеза млекопитающих. Полученные ими результаты были положены в основу правил доклинической проверки лекарственных препаратов на тератогенную и эмбриотоксическую активность, утвержденных Минздравом СССР (1972 г., 1986 г.) и внедренных в здравоохранение. Результаты научно-исследовательской работы Отдела эмбриологии внесли существенный вклад в понимание взаимодействия генетических, эпигеномных и внешних факторов в развитии организма.
Именно в Отделе эмбриологии ИЭМ впервые в СССР осуществили успешный перенос генов человека в геном мышей и крыс. Впервые в мире получили трансгенных мышей и крыс, у которых экспрессия гена гормона роста человека привела к двум противоположным эффектам (животные-гиганты с ускоренным ростом, и карлики — с гипофизарным нанизмом). Эти работы заложили основы для поиска путей коррекции наследственных болезней человека путем генной терапии, открыли перспективы развития медицинской биотехнологии, создания животных-продуцентов биологически активных веществ (т.е. в современном понимании — генетически модифицированных организмов).
В 1991 г. Отдел эмбриологии вошёл в состав нового отдела ИЭМ — Отдела молекулярной генетики. В конце 2000 г. доктором биологических наук Евгением Львовичем Паткиным была создана Лаборатория молекулярной цитогенетики развития млекопитающих, которая продолжает исследовательские традиции своих предшественников в области фундаментальной и прикладной биомедицины, с учётом современных потребностей медицины.
Еще в 1980-х гг. Е.Л. Паткиным с сотрудниками были выявлены пространственные перестройки блоков С-гетерохроматина в интерфазных ядрах эмбрионов млекопитающих на доимплантационных стадиях развития, что указывало на роль гетерохроматина в пространственной организации хромосом в ядре, а также в процессе первичной дифференцировки клеток. Были обнаружены различия в уровне метилирования ДНК материнского и отцовского геномов у зародышей и асимметрия сестринских хроматид по однонитевым разрывам ДНК. Было показано, что обработка клеток позвоночных 5-азацитидином (5азаC) или его аналогами вызывает заметное увеличение сестринских хроматидных обменов, которые, как предполагалось, являются результатом деметилирования ДНК.
В середине 90-х гг прошлого века Е.Л. Паткиным было высказано предположение, что асимметричное метилирование сестринских хроматид на доимплантационных стадиях эмбриогенеза является специфической характеристикой потенциала или состояния дифференцировки и, следовательно, может быть использовано в качестве маркера эмбриональных, прогениторных и взрослых стволовых клеток, влияния окружающей среды на деление клеток или указывать на заболевания, связанные с дифференцировкой и/или дедифференцировкой, что в дальнейшем и было подтверждено многочисленными работами не только сотрудников Отдела молекулярной генетики, но и других отечественных и зарубежных исследователей. Асимметричное метилирование сестринских хроматид было выявлено не только у доимплантационных зародышей, но и в культурах клеток F9 эмбриональной тератокарциномы мыши, и этот эффект может приводить к асимметричным клеточным делениям и асимметричному транскрипционному статусу дочерних клеток.
Сотрудниками Лаборатории в начале 2000-х гг. в клетках F9, трансфицированных фрагментом (3,8 т.п.н.) бычьей сателлитной ДНК IV (Sat), была выявлена тенденция его распространения вдоль хромосом. Участки с интегрированным транс-сателлитом были обогащены одноцепочечными разрывами ДНК, которые не были метилированы и, по-видимому, представляли собой интермедиаты нестабильности чужеродной ДНК из-за неравных обменов сестринских хроматид. У мышей, трансгенных по Sat, была обнаружена межгенерационная нестабильность чужеродной ДНК, которая сопровождалась пренатальной летальностью трансгенных зародышей при наследовании от самцов. В основе нестабильности Sat лежали внутриаллельные процессы, которые, как предполагалось, протекали в премейотический период гаметогенеза и/или в раннем эмбриогенезе. При наследовании Sat от самок стабильность трансгена «восстанавливалась» и не приводила к эмбриональной летальности. У гемизиготных трансгенных самок инсерция чужеродной сателлитной ДНК была связана с повышенной частотой возникновения опухоли молочной железы, воспалительными процессами в рогах матки и нарушением поведения (материнский каннибализм).
Под руководством Евгения Львовича сотрудниками Лаборатории были выявлены ассоциации коротких аллелей минисателлита UPS29 гена центаурина бета 5 (ACAP3) с риском развития болезни Паркинсона и эпилепсии у женщин. Показана связь UPS29 с цереброваскулярными патологиями, структурными изменениями головного мозга, неврологическим статусом и клинической картиной судорог как у женщин, так и у мужчин с эпилепсией. Были получены предварительные данные о возможности существования связи между носительством коротких аллелей (38 и 33 повтора) B2-VNTR и кардиопротективными эффектами рецептора В2 брадикинина у женщин с ишемической болезнью сердца.
| Фотогалерея к разделу История Лаборатории молекулярной цитогенетики развития млекопитающих | |
 |
Иванов Пётр Павлович (09.04.1878 – 15.02.1942) — доктор наук, профессор (1934 г.) |
 |
Светлов Павел Григорьевич (28.08.1892 – 07.07. 1974) — доктор медицинских наук, профессор, член-корреспондент АМН СССР (1946 г.), лауреат Государственной премии СССР (1968 г.) |
 |
Дыбан Андрей Павлович (18.04.1922 – 24.02.2013) — доктор медицинских наук, профессор, заслуженный деятель науки РФ (1998 г.), почётный доктор ИЭМ СЗО РАМН (2000 г.), Почётный доктор Национального общества регенеративной медицины (2014 г.) |
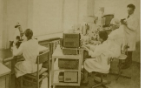 |
В кабинете Лаборатории цитогенетики раннего развития млекопитающих Отдела эмбриологии (1984 г.). Правый справа за микроскопом д.м.н., профессор А.П. Дыбан. |
 |
Сотрудники Отдела со студентами СПбГУ (2003 г.).
От центра по часовой стрелке: к.б.н. Сасина Л.К., д.б.н. Паткин Е.Л., д.м.н. Васильев В.Б., студенты Кафедры цитологии и гистологии — Ильина Н.С., Богуш Е.А. и ?, к.б.н. Сучкова И.О. и прикомандированный аспирант Сломинская Н.А. (Киевский национальный университет им. Т. Шевченко, Биологический факультет, Кафедра цитологии, гистологии и репродуктивной медицины) |
 |
За написанием научной публикации (2008 г.) д.м.н. Дыбан П.А. и к.б.н. Нониашвили Е.М. |
 |
Оценка результатов транформации E. coli рекомбинантным плазмидным вектором pEGFP-UPS29 (2010 г.) к.б.н. Сучковой И.О. и к.б.н. Федоровой Е.М. |
 |
За обсуждением результатов (2015 г.). Слева направо: к.б.н. Сасина Л.К., к.б.н. Сучкова И.О., к.б.н. Павлинова Л.И. и д.б.н. Паткин Е.Л. |
 |
Работа с доимплантационными зародышами мыши к.б.н. Нониашвили Е.М. (2018 г.) |
 |
Анализ цитологических препаратов за фазово-контрастным микроскопом н.с. Дергачевой Н.И. (2018 г.) |
 |
Работа с доимплантационными зародышами мыши. м.н.с. Челышева (Постникова) Л.А. (2023 г.) |
Сотрудничество
- Отдел генетики и клеточной токсикологии Стокгольмского Университета (Department of Genetics and Cellular toxicology, Wallenberg Laboratory, Stockholm University, Stockholm, Sweden) (Head of the Department Prof. Dr. Ulf Rannug). Тема исследований «Mitotic minisatellite instability in yeast and pluripotent embryonal carcinoma cells» (2002–2004 гг.).
- Лаборатория сердечно-сосудистых и эндокринных заболеваний Макс-Дельбрюк Центра Молекулярной медицины (Берлин, Германия) (Lab. Cardiovascular and Metabolic Disease, Max-Delbruck-Center for Molecular Medicine, Berlin-Buch, Germany) (Head of lab. prof. Dr. Michael Bader). Тема исследований: «Derivation of germ line competent rat ES cells for gene targeting» (2009–2010 гг.).
- Российско-Вьетнамский тропический научно-исследовательский и технологический центр. Институт тропической медицины и биологии (рук. Во Вьет Кыонг) (Куанг Чи, Куанг Бинь, Социалистическая Республика Вьетнам). Тема исследования: «Генетический полиморфизм и эпигенетические модификации генов у взрослых и их детей, проживающих на загрязненных экотоксикантами территориях Вьетнама» (2015–2016 гг.).
- ФГУП «Научно-исследовательский институт гигиены, профпатологии и экологии человека» Федерального медико-биологического агентства. Тема исследования: «Изучение влияния экотоксикантов на эпигенетические модификации в эмбриональных тканях после коррекции токсического поражения направленно дифференцированными ЭСК» (2013–2017 гг.)
- ФГБУН Институт биохимии и генетики УНЦ РАН, Отдел геномики (зав. Отделом д.б.н., проф. Хуснутдинова Э.К.), Лаборатория физиологической генетики человека (зав. лаб. д.б.н., проф. Мустафина О.Е.) (г. Уфа, Республика Башкортостан) (2008–2010 гг.).
- Башкирский педагогический университет имени М. Акмуллы. Естественно-географический факультет. Кафедра генетики. (г. Уфа, Республика Башкортостан) (2012 г.).
- ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека. Лаб. персонализированной медицины (зав. д.м.н. Баирова Т.А.) (г. Иркутск) (2017 г.).
- СПбПУ Петра Великого. Факультет медицинский физики и биоинженерии (кафедра физико-химических основ медицины). Физико-механический факультет (кафедра биофизики) (1999–2008 гг.).
- Российский государственный педагогический университет им. А.И. Герцена. Кафедра зоологии (2015–2017 гг.).
- ФГБОУ ВО «Воронежский государственный университет». Медико-биологический факультет. Кафедра биохимии и физиологии клетки (2013–2018 гг.).
- СПбГУ. Биолого-почвенный факультет. Кафедры биохимии, эмбриологии, генетики и селекции (генетики и биотехнологии) (с 1995 г. по настоящее время).
- ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова. Научно-образовательный институт биомедицины. Лаборатория биофизики кровообращения (зав. д.м.н. М.Г. Плисс) (с 2016 г. по настоящее время).
Основные направления исследований
В Лаборатории молекулярной цитогенетики развития млекопитающих в течение многих лет исследуются in vivo и in vitro генетические и эпигенетические механизмы развития социально-значимых болезней человека, а также эмбриогенеза млекопитающих в норме и при воздействии различных веществ или после перенесенной психогенной травмы.
Первое направление исследований Лаборатории заключается в поиске новых генетических и эпигенетических/эпигеномных маркеров риска развития сердечно-сосудистых, неврологических, психических и онкологических заболеваний. Особое внимание уделяется изучению молекулярных механизмов влияния некодирующих тандемных повторов (локализованных в интронах и нетранслируемых районах генов) в эпигенетической регуляции экспрессии генов в процессе дифференцировки клеток, а также при различных заболеваниях. Результаты таких исследований могут быть полезны в ДНК-диагностике и разработке новых эффективных методов профилактики и лечения.
Второе направление исследований Лаборатории — это изучение на молекулярном, клеточном, тканевом и организменном уровнях эпигенетических и эпигеномных изменений (метилирование ДНК, модификации гистонов), вызванных воздействием различных веществ (в частности, экотоксикантов и лекарственных препаратов) или психологической травмой. Результаты таких исследований могут внести вклад в разработку тест-систем и методических указаний, необходимых для скрининга повреждающих факторов, а также способов возможной коррекции повышенной восприимчивости к токсикантам или психоэмоциональному воздействию с помощью так называемых «эпигенетических» лекарств. Основные задачи таких исследований:
- выявление эпигенетических и эпигеномных модификаций, возникающих под влиянием различных веществ (или стресса) в первичных половых клетках, на до- и постимплантационных стадиях эмбриогенеза, а также в постнатальный период развития, а также установление их роли в риске развития заболеваний (отдаленные последствия, развитие «взрослых» заболеваний);
- определение особенностей наследования эпигенетических/эпигеномных модификаций как в ходе онтогенеза особей, подвергшихся воздействию экстремальных факторов среды обитания или психической травме, так и в ряду поколений (межгенерационное наследование). Оценка характера влияния такого рода воздействий на эпигенетические и эпигеномные изменения у потомства экспонированных животных и людей.
В настоящее время совместно с сотрудниками Лаборатории психофизиологии эмоций (зав. лаб. проф., д.м.н. С.Г. Цикунов) Отдела физиологии им. И.П. Павлова проводятся исследования по влиянию витального стресса на эпигенетические и эпигеномные изменения (метилирование ДНК и хроматина) у лабораторных животных. Также проводится изучение возможного использования лактоферрина как «нормализатора» эпигеномных модификаций, индуцированных экотоксикантами и витальным стрессом.
Основные научные результаты за последние 5 лет
- Выявлены гендерные различия риска развития кардиологических (инфаркт миокарда) и цереброваскулярных (дисциркуляторная энцефалопатия, ишемический инсульт) осложнений при гипертонической болезни и ишемической болезни сердца.
- У пациентов с гипертонической болезнью и ишемической болезнью сердца обнаружен широкий межиндивидуальный разброс значений уровня полногеномного метилирования ДНК и степени компактизации хроматина.
- Показано, что бисфенол А и хлорид кадмия изменяют эпигеномный статус (метилирование ДНК и компактизацию хроматина) и влияют на пролиферацию клеток HepG2, HEK293, IMR-32, FetMSC человека. Степень выраженности выявленных эпигеномных изменений зависит от дозы экотоксиканта и типа клеток, что во многом может объясняться исходными генетическими, эпигенетическими и биохимическими особенностями этих клеток, в том числе степенью их дифференцированности и наличием рецепторов к эстрогену. Полученные результаты могут указывать на разные молекулярные пути воздействия этих поллютантов в исследованных линиях клеток.
- Выявлено, что бисфенол А и хлорид кадмия приводят к эпигеномным изменениям (метилирование ДНК и гистона H3K27) и влияют на до- и постимплантационное развитие мышей, при этом возникшие в результате воздействия эпигеномные нарушения могут наследоваться в ряду поколений.
- Установлено, что у постимплантационных эмбрионов мыши экзогенный апо-лактоферрин человека приводит к нормализации уровней полногеномного метилирования ДНК после индуцированных бисфенолом А эпигенетических нарушений.
- Обнаружено, что апо-форма рекомбинантного лактоферрина человека влияет на жизнеспособность и эпигеномный статус клеток нейробластомы IMR-32.
- Выявлено нарушение эстрального цикла и снижение уровня полногеномного метилирования ДНК в лейкоцитах периферической крови и клетках костного мозга у самок крыс, перенесших психогенную травму, связанную с угрозой жизни (витальный стресс). У крыс эпигеномные изменения, возникшие в результате психологической травмы (витальный стресс), сохраняются в клетках крови как минимум на протяжении месяца. У самок крыс, переживших психогенную травму, наблюдаются нарушения в репродуктивной системе, проявлением которых может быть ановуляторный синдром, связанный с нарушением оогенеза.
Сотрудники лаборатории: 
Нониашвили Екатерина Михайловна — старший научный сотрудник, кандидат биологических наук Сфера научных интересов: особенности эмбриогенеза лабораторных животных (до – и постимплантационное развитие) в норме и после воздействия различных веществ

Сасина Людмила Константиновна — старший научный сотрудник, кандидат биологических наук Сфера научных интересов: эпигенетические изменения после воздействие экотоксикантов и фармакологических препаратов (исследования на культурах клеток человека и лабораторных животных)

Сучкова Ирина Олеговна — старший научный сотрудник, кандидат биологических наук Сфера научных интересов: генетические (полиморфизм тандемных повторов ДНК), эпигенетические и эпигеномные изменения при кардиологических, цереброваскулярных патологиях, нейропсихических расстройствах и после воздействие различных факторов (экотоксиканты, фармакологические препараты и др.)

Кустова Мария Евгеньевна — младший научный сотрудник, кандидат биологических наук Сфера научных интересов: эмбриогенез мыши, трансмитохондрильные животные, особенности межгенерационного наследования чужеродной мтДНК, моделирование «болезней окислительного фосфорилирования»

Баранова Татьяна Валерьевна — младший научный сотрудник, кандидат биологических наук Сфера научных интересов: цитогенетика, межгенерационное наследование чужеродной ДНК
Наиболее значимые публикации Лаборатории молекулярной цитогенетики развития млекопитающих
- Сучкова И.О., Дергачева Н.И., Соколова В.А., Фирова Э.М., Мамедова З.Э., Мещерякова Н.Г., Агибалова Л.Т., Шурпач С.Л., Сасина Л.К., Баранова Т.В., Муружева З.М., Татаринов А.Е., Паткин Е.Л. Эпигеномные изменения в лейкоцитах периферической крови у пациентов с гипертонической болезнью и дисциркуляторной энцефалопатией // Медицинская генетика. 2022. 21(11):67-70. DOI: 10.25557/2073-7998.2022.11.67-70.
- Сучкова И.О., Шарруф К.А., Сасина Л.К., Дергачева Н.И., Баранова Т.В., Паткин Е.Л. Апо-форма рекомбинантного лактоферрина человека изменяет уровень полногеномного метилирования ДНК и степень компактизации хроматина в клеточной линии нейробластомы IMR-32 // Медицинский академический журнал. 2022. 22(4):77–96. DOI: 10.17816/MAJ112498.
- Postnikova L.A, Noniashvili E.M., Suchkova I.O., Baranova T.V., Patkin E.L. The influence of exogenic lactoferrin on DNA methylation in postimplantation mouse embryos developed from zygotes exposed to bisphenol A // Medical Academic Journal. 2022. 22(4): 13-23. DOI:10.17816/MAJ109416.
- Suchkova I.O.; Borisova E.V.; Patkin E.L. Length Polymorphism and Methylation Status of UPS29 Minisatellite of the ACAP3 Gene as Molecular Biomarker of Epilepsy. Sex Differences in Seizure Types and Symptoms // Int. J. Mol. Sci. 2020. 21:9206. DOI: 10.3390/ijms21239206.
- Дергачева Н.И., Сучкова И.О., Сасина Л.К., Нониашвили Е.М., Стасовская А.В., Баранова Т.В., Софронов Г.А., Паткин Е.Л. Влияние бисфенола А на митотическую активность в клеточных линиях человека различного происхождения // Цитология. 2019. 61(10):823-836. DOI: 10.1134/S0041377119100043.
- Suchkova I.O., Sasina L.K., Dergacheva N.I., Sofronov G.A., Patkin E.L. The influence of low dose Bisphenol A on whole genome DNA methylation and chromatin compaction in different human cell lines // Toxicology in Vitro. 2019. 58:16-34. DOI: 10.1016/j.tiv.2019.03.010.
- Паткин Е.Л., Софронов Г.А. Эпигенетические изменения как общий механизм заболеваний, старения и токсического действия химических веществ // СПб: Эко-Вектор, 2019. – 239 с. ISBN: 978-5-907201-11-8.
- Сучкова И.О., Нониашвили Е.М., Дергачева Н.И., Чан В.Ч., Сасина Л.К., Т.В. Баранова, Софронов Г.А., Джапаридзе Л.А., Паткин Е.Л. Влияние бисфенола А на уровень полногеномного метилирования ДНК в разных частях тела мыши на 12 день эмбрионального развития // Региональная экология. 2018. 53(3):96-110. DOI: 10.30694/1026-5600-2018-3-96-110.
- Нониашвили Е.М., Грудинина Н.А., Кустова М.Е., Чан В.Ч., Сучкова И.О., Павлинова Л.И., Сасина Л.К., Дергачева Н.И., Софронов Г.А., Паткин Е.Л. Метилирование ДНК в раннем эмбриогенезе мышей под влиянием бисфенола А // Экологическая генетика. 2017. 15(3):42-53. DOI: 10.17816/ecogen15342-53.
- Belotserkovskaya E.V., Suchkova I.O., Borisova E.V., Borovkova N.K., Pavlinova L.I., Patkin E.L. Concurrent changes of CSTB and ACAP3 genes expression in symptomatic epilepsy and Parkinson’s disease // Международный научно-исследовательский журнал. 2017. 66(12) (часть 4):96-103.
- Patkin E.L., Grudinina N.A., Sasina L.K., Noniashvili E.M., Pavlinova L.I., Suchkova I.O., Kustova M.E., Sofronov G.A. DNA methylation differs between sister chromatids, and this difference correlates with the degree of differentiation potential // Mol. Rep. Develop. 2015. 82(10): 724-725. DOIi: 10.1002/mrd.22519.
