На недавно прошедшем в Петербурге VI Инновационном медицинском форуме заместитель заведующего отделом молекулярной микробиологии ИЭМ, к.б.н. Анна Николаевна Цапиева выступила с докладом «Онколитические бактерии в терапии опухолей». В своем выступлении исследователь доложила о последних результатах в области поиска эффективных штаммов и их продуктов для создания новых противоопухолевых препаратов.
«Цель нашего исследования, – рассказала А.Н. Цапиева нашему сайту, – изучить способность живых бактерий (в частности, стрептококков группы А, S. pyogenes) воздействовать на злокачественные опухоли. На данный момент мы провели эксперимент in vitro в отношении различных клеточных опухолевый линий, и кроме этого, на культуре нативных опухолей, полученных от пациентов. В результате, мы нашли несколько штаммов S. Pyogenes, которые способны подавлять и убивать злокачественные новообразования. Более того, мы провели контрольное исследование в отношении нормальных клеток человека, и показали, что онколитические штаммы совершенно безопасны для здоровых тканей.
Кстати, эффективность некоторых бактериальных штаммов в отношении уничтожения опухолей показана не только нами, но и мировым научным сообществом, поскольку эта тема – способность некоторых бактерий подавлять опухолевый рост – изучается уже довольно длительное время. Например, накоплен уже довольно большой опыт спонтанного излечения от раковых заболеваний на фоне инфекции, в частности, инфекции, вызванной патогенными бактериями. Впервые этот эффект – способность стрептококков использовать для своей колонизации злокачественные опухоли – был использован американским врачом Уильямом Коли, который обнаружил, что один из пациентов, больной неоперабельной саркомой, полностью вылечился от рака после перенесенной стрептококковой инфекции (Coley, 1883). У семилетнего пациента была диагностирована рожа, и вместе с выздоровлением пациента после инфекции было зафиксировано уменьшение, а затем и полное исчезновение опухоли.
К настоящему времени накоплен большой опыт применения различных видов онколитических бактерий как на модельных экспериментах на лабораторных животных или культурах ткани, так и в условиях клинических апробаций. Так, американские ученые показали способность клеток Salmonella подавлять размножение клеток опухоли (Pawelek et al., 1997). Аналогичные результаты были получены с применением Streptococcus (Maletzki et al., 2008), Listeria (Kim et al., 2009), Escherichia (Yu et al., 2004), Lactobacillus (Motevaseli et al., 2018), Clostridium (Malmgrenand Flanigan, 1955), Bifi dobacterium (Kohwi et al., 1978), Caulobacter (Bhatnagar et al., 2006), Proteus (Arakawa et al., 1968), Klebsiella (Hetz et al., 2002), Mycobacterium (Morales, 2017) и ряда других бактерий.
Словом, исследования в данной области идут по всему миру довольно активно, и мы стараемся идти в ногу с мировым сообществом. Надо отметить, что на сегодня до конца не изучены механизмы воздействия бактерий на опухолевые клетки. Например, оказалось, что некоторые бактериальные виды предпочитают колонизировать ткань опухли за счет способности развиваться в среде с низким содержанием кислорода и, с другой стороны, за счет привлекательности микроокружения опухоли, содержащего целый ряд ценных для бактериальных клеток метаболитов. В итоге, механизмы бактериальной транслокации в область солидной опухоли сейчас сводятся к трем основным причинам.
Первая связана с тем, что хаотическая сосудистая сеть опухоли приводит к образованию гипоксически-некротических участков, которые создают идеальные условия для развития облигатных анаэробов: им очень выгодно находиться там, где кислорода нет. Кстати, никакие препараты в эти области новообразований попасть не могут, а бактерии как раз стремятся туда. Сейчас даже есть исследования, когда к бактериям «пришивают» лечебные вещества, используя их, как средство доставки.
Вторая причина, по которой бактерии устремляются в опухоли – это питательные вещества, высвобождаемые из некротических опухолевых клеток, которые как раз поддерживают рост и пролиферацию бактерий.
Наконец, третья причина: бактериальные клетки «стремятся» в область образования опухоли, так как микроокружение опухоли сильно иммуносупрессивно и опухолевые ткани становятся идеальной гаванью для выживания бактерий, которые «прячутся» в опухоли от уничтожения иммунной системой хозяина.
Важно заметить, что разыскать противоопухолевые штаммы очень нелегко – необходимо провести скрининг довольно большого количества различных штаммов микроорганизмов, в том числе, высоко вирулентных, чтобы найти именно те, что обладают онколитическими свойствами. И затем попытаться снизить его патогенность.
Как известно, основным фактором патогенности S. pyogenes является ассоциированный с его клеточной стенкой М-белок. С целью снижения потенциальной опасности живых стрептококков для организма был сконструирован штамм S. pyogenes, GURSA1 серотипа M111, лишенный М-белка. Мы получили нокаунт-мутант по М-белку – штамм, который мы сейчас используем в исследовании, выполнив его полногеномное секвенирование. Он совершенно безопасен для организма и при этом – что удивительно! – его эффективность против опухоли даже выше, чем у патогенного штамма.
Понятно, что успех клинического применения бактерий в терапии опухолей зависит от
многих факторов, таких как доступность опухоли, ее состояние, ее тип, а также других факторов. Возможно, в дальнейшем будет целесообразно конструировать онколитические бактерии с повышенной экспрессией тех факторов, включая наночастицы и химиопрепараты, которые обеспечивают максимально полезные и эффективные противоопухолевые реакции».
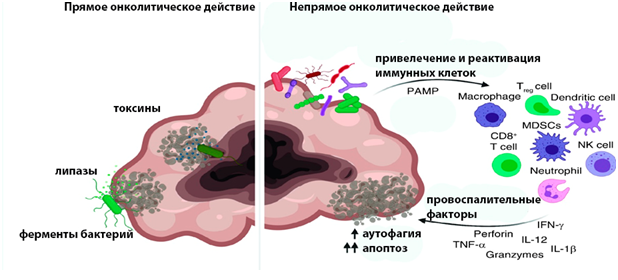
Основные механизмы действия бактерий в отношении опухолевых клеток (адаптировано из Wang et al., 2019)